PrimaryOdors.org molecular docker.
http://www.primaryodors.org
400 on geo$₽µTA£ в@℞dbite; 400 on the ground NOW ©lEAR, ny!
Я®ÆJLi© WOИ
Эксклюзивный ЭКµΛΛ* MikE HA₽Å©₾EO'И.ß.@
*Λ = ©he_Λёв_Ekµ
MAiSTRE Mjau ₽µ©ho (ფიჩო), known fi©ho "KATE.A" known more about receptors ОбояниЯ, чем МенДеЛёвი, but komisk situation hon's har skappat! Heja hon's!
Men'de'£ёvi'$ ß.
PrimaryDock is a lightweight stochastic molecular docking software package that offers the following advantages:
- Path-based docking;
- Native support for side-chain flexion;
- Per-residue binding strength output;
- Per-binding-type binding strength output;
- Per-residue van der Waals proximity repulsion output;
- Small self contained codebase with no extraordinary dependencies;
- Does not require CMake, but can be built on any recent *nix system using make, g++, and the C++14 Standard Library;
- Interatomic parameters stored in flat text files that can be edited without recompiling the application.
PrimaryDock comes with Pepteditor, a tool for editing proteins using a scripting language.
PrimaryDock also offers a web interface that allows you to run a local copy of the same data explorer pages that power the PrimaryOdors website.
To use PrimaryDock and Pepteditor, please first clone the repository, then execute the following commands:
make primarydock
make pepteditor
If you are a developer contributing to the project, you can use make to build everything and run the test reports, or
make code to just build the code and run only the amino aldehyde test. This test is critical to the function of PrimaryDock
because any change to the code that causes it to fail, means the docking functionality will be impaired. (If it fails, just
try running make code again. Usually it will take a few tries. It is hoped to one day have this test succeed every time.)
The application will require 3D maps of your target receptor(s) in PDB format. Please note that PrimaryDock does not currently hydrogenate PDB models that do not include hydrogen atoms, so if your model contains heavy atoms only, the accuracy of docking results may be severely compromised. PDBs for human olfactory receptors are provided in the pdbs folder for olfactory docking. They have been modified from the PDBs available at the GPCR-I-TASSER website: https://zhanggroup.org/GPCR-I-TASSER/
It will also be necessary to obtain 3D models of your ligand(s). Currently, only SDF format is supported. SDFs can be obtained a few different ways:
- If you have obabel, you can generate 3 dimensional SDFs from SMILES input. Example syntax:
obabel -:'CCO' --gen3D -osdf -Oethanol.sdf - SDFs are available from PubChem at https://pubchem.ncbi.nlm.nih.gov/rest/pug/compound/cid/{pubchem_cid}/SDF?record_type=3d
- Or at https://pubchem.ncbi.nlm.nih.gov/rest/pug/compound/smiles/{SMILES}/SDF?record_type=3d
Please take a look at the primarydock.config file as a sample of the format for dock settings. You will be editing this file (or creating a new one) for each receptor+ligand pair that you wish to dock. There are lines for repointing to your PDB and SDF model input files, as well as various other options that may be useful to your purposes.
Known issue: please make sure to add an empty line at the end of your config file, or primarydock will throw an exception.
Once your .config file is ready, and the PrimaryDock code is compiled, simply cd to the primarydock folder and run the following command:
./bin/primarydock [config file]
(...replacing "[config file]" with the actual name of your config file.)
After a little while, depending on your config settings, PrimaryDock will output data about one or more poses, including binding energy per residue, binding energy per type, total binding energy, PDB data of the ligand, and (if flexing is enabled) PDB data of the binding residues. This output can be captured and parsed by external code, written in your language of choice, for further computation, storage in a database, etc.
Note if PrimaryDock does not output any poses, please try rerunning it a few times until it gives results. PrimaryDock has pseudo-random calculations built in so that its output will be different each time, so that rerunning the application can catch poses that previous runs may have missed.
If you would like to contribute to this project:
- I would be sooo very grateful for the help!
- Please create a branch off of stable, then submit a pull request;
- All PRs that change the C++ classes or the primarydock app must pass the Big Three test (see the test/big_three file), and receive an all clear 🟩🟩🟩 message, before merge.
- Use whichever { style you prefer; as long as the code is readable and it works, that's all I care about.
- Have fun and try not to let the project vex you. (:
Note to developers: if you run PrimaryDock under a memory utility such as valgrind, you are likely to see a lot of errors saying that uninitialized variables are being used or that conditional jumps depend on them. Most of these are false positives. Many places in the code create temporary arrays of pointers and then assign those pointers addresses of objects that persist throughout the entire program execution. The memory tool "thinks" the objects have not been initialized even when they have. We recommend using the --undef-value-errors=no option with valgrind or the equivalent switch in your utility of choice.
You may now host your own PrimaryDock web interface for viewing the contents of the JSON files in the data folder. It is the same web application as is used for the Primary Odors website.
To enable the web app, either set up a local web server or checkout primarydock in a folder on a web host. Make sure your server has the
php and php-gd packages installed. Then open the www/symlink.sh file in a text editor, make sure the destination folder is correct (by
default it will show /var/www/html/ which is usually correct for Apache2 installations), make sure you have write permissions in the
folder (or use sudo), and execute www/symlink.sh in a command line. If on a local server, you will now have an instance of the web app
at http://127.0.0.1/primarydock/ whereas if you are using a web host then you may have to configure your hosting to point one of your
registered domains or subfolders to the primarydock/www folder.
Easily Memorize the Genetic Code:
About O₽eracional Re©eptor$ in no®se: https://www.biorxiv.org/content/10.1101/2022.12.20.520951v1.full ha в@₽Дegинал ДиАлект Фи3икА©hemie .₽µ u₽.:
google© MA©hine T®
биоЯRxiv
ДОМ О ПРЕДСТАВЛЯТЬ НА ПРАССМОТРЕНИЕ ПРЕДУПРЕЖДЕНИЯ / ЯRSS П.₽.ß.*
П®µскать это ключевое слово
П®иск
ПRÅ©ширенный п®иск
hовые ПRезультаты
Структурные основы распознавания запахов рецептором запаха человека Посмотреть профиль ORCIDКристиан Б. Биллесбёлле , Посмотреть профиль ORCIDКлэр А. де Марч , Посмотреть профиль ORCIDВейнанд Дж. К. ван дер Велден , Нин Ма , Посмотреть профиль ORCIDДживан Тевари ,Клаудия Ллинас дель Торрент , Линус Ли Посмотреть профиль ORCIDБрайан Фауст , Посмотреть профиль ORCIDНагараджан Вайдехи , Посмотреть профиль ORCIDХироаки Мацунами , Посмотреть профиль ORCIDАашиш Манглик Дои:https://doi.org/10.1101/2022.12.20.520951 АбстрактныйПолный текстИнформация/ИсторияМетрикиПредварительный просмотр PDF Абстрактный Наше обоняние позволяет нам ориентироваться в огромном пространстве химически разнообразных молекул запаха. Эта задача решается путем комбинаторной активации примерно 400 обонятельных рецепторов, связанных с G-белком (GPCR), закодированных в геноме человека 1–3 .. Как одоранты распознаются обонятельными рецепторами (ОР), остается загадкой. Здесь мы обеспечиваем механистическое понимание того, как одорант связывается с обонятельным рецептором человека. Используя криогенную электронную микроскопию (крио-ЭМ), мы определили структуру активного человеческого OR51E2, связанного с пропионатом жирной кислоты. Пропионат связывается внутри закрытого кармана в OR51E2 и образует специфические контакты, важные для активации рецептора. Мутация кармана связывания одоранта в OR51E2 изменяет спектр распознавания жирных кислот с различной длиной цепи, указывая на то, что избирательность одоранта контролируется тесными взаимодействиями упаковки между одорантом и обонятельным рецептором. Моделирование молекулярной динамики демонстрирует индуцированные пропионатом конформационные изменения во внеклеточной петле 3 для активации OR51E2. Вместе,
ВВЕДЕНИЕ Наше обоняние зависит от нашей способности обнаруживать и различать широкий спектр летучих молекул запаха. Однако огромное химическое разнообразие потенциальных одорантов представляет собой главную проблему для обонятельной системы всех животных. У позвоночных одоранты обнаруживаются обонятельными рецепторами (ORs), которые представляют собой рецепторы , связанные с G-белком (GPCRs), экспрессируемые в обонятельных сенсорных нейронах ( OSNs), выступающих из обонятельного эпителия в обонятельную луковицу в головном мозге 1,3 . Чтобы обнаружить и различить огромное разнообразие потенциальных пахучих веществ 4 , семейство генов OR было значительно расширено в геномах позвоночных, при этом некоторые виды кодируют тысячи генов OR 5 .. У человека около 400 функциональных OR составляют половину более широкого семейства GPCR класса A ( Fig. 1a ) 6 , 7 .
Рисунок 1. Скачать рисунокОткрыть в новой вкладке Рисунок 1. Структура обонятельного рецептора OR51E2 человека. а) Филогенетическое дерево GPCR класса А человека, включая как необонятельные (синие), так и обонятельные рецепторы. Обонятельные рецепторы делятся на класс I (зеленый) и класс II (оранжевый). OR51E2 является OR класса I. Шкала филогенетического расстояния представлена в левом нижнем углу (расстояние соответствует 9% различий между последовательностями). b) Мониторинг концентрации цАМФ в режиме реального времени, показывающий, что человеческий OR51E2 реагирует на одорант пропионат. Точки данных представляют собой среднее значение ± стандартное отклонение от n = 4 повторов. Карта плотности крио-ЭМ ( c ) и ленточная модель ( d ) активного человеческого OR51E2, связанного с пропионатом (желтые сферы) в комплексе с гетеротримером Gs и стабилизирующим нанотелом Nb35.
Одорантная стимуляция ORs активирует сигнальные пути через стимулирующий G-белок G olf , что в конечном итоге приводит к возбуждению OSNs 8 . Каждый OR может взаимодействовать только с подмножеством всех потенциальных одорантов. И наоборот, один одорант может активировать несколько OR 2 . Этот принцип молекулярного распознавания обеспечивает центральную нейронную логику обоняния, где восприятие запаха возникает в результате комбинаторной активности множества уникальных OR, которые реагируют на индивидуальный запах 2 . Поскольку каждый зрелый OSN экспрессирует только один ген OR 9 , понимание того, как активируется индивидуальный OR, обеспечивает прямое понимание сенсорного кодирования обоняния.
Чтобы понять обоняние на фундаментальном уровне, нам нужна структурная схема, описывающая, как одоранты распознаются OR. Хотя недавние структуры управляемых запахом ионных каналов насекомых начали расшифровывать эту молекулярную логику 10 , 11 , молекулярные правила, управляющие распознаванием запаха в OR позвоночных, вероятно, различны и остаются неясными. Здесь мы использовали криогенную электронную микроскопию (крио-ЭМ) для определения структуры ОР человека, активированного одорантом. Эта структура выявляет специфические молекулярные взаимодействия, которые управляют распознаванием запаха, и обеспечивает основу для понимания того, как связывание запаха активирует ORs для запуска клеточной передачи сигналов.
Структура связанного одоранта OR51E2 Несколько проблем имеют ограниченные структурные исследования OR позвоночных, включая низкие уровни экспрессии в гетерологичных системах, низкую растворимость большинства летучих одорантов и резкую нестабильность очищенных OR 12-15 . Поэтому мы стремились определить человеческий операционный, который преодолевает эти проблемы. Мы определили приоритет подмножества ORs, которые также экспрессируются в тканях вне OSNs с хеморецептивными функциями, которые не зависят от обоняния 16 . Способность этих ОР функционировать в необонятельных тканях предполагает, что они могут быть более восприимчивы к экспрессии в гетерологичных клеточных системах экспрессии, в которых отсутствуют шапероны, специфичные для обонятельных тканей 13. Во второй линии рассуждений мы отдали предпочтение классу I (так называемые «рыбоподобные») OR, поскольку эти рецепторы обычно распознают водорастворимые одоранты 17 . Напротив, OR класса II, как правило, реагируют на более гидрофобные одоранты. Наконец, мы отдали предпочтение OR, которые в значительной степени сохранялись в ходе эволюции, возможно, потому, что они распознают одоранты, которые имеют решающее значение для выживания животных у многих видов 5 . Мы пришли к выводу, что такие ОС могут быть более ограничены эволюцией для обеспечения стабильности. При таком подходе мы идентифицировали OR51E2 человека как идеального кандидата для определения структуры ( дополнительная рис. 1 ). OR51E2 представляет собой OR класса I, который реагирует на пропионат короткоцепочечной жирной кислоты 18 ( рис. 1a,b).). В дополнение к своей обонятельной функции , OR51E2 и его мышиный гомолог Olfr78 экспрессируются в некоторых др. тканях, чтобы обеспечить хеморецепцию короткоцепочечных жирных кислот 19-24 . В соответствии с нашими рассуждениями, OR51E2 появился как один из наиболее высоко экспрессируемых OR в клетках HEK293T среди сотен человеческих и мышиных OR, которые мы тестировали ранее 12 .
Для дальнейшей стабилизации OR51E2 мы стремились выделить OR51E2 в комплексе с гетеротримерным G-белком. OR соединяются с двумя высоко гомологичными стимулирующими G-белками Gα olf и Gα s . В зрелых OSNs ORs активируют Gα olf , чтобы стимулировать продукцию цАМФ посредством adenylyl cyclase 8 . В незрелых OSNs ORs активируют adenylyl cyclase через Gαs, чтобы управлять точным нацеливанием на передне-задние аксоны 25 . Более того, OR51E2 передает сигналы через Gαs вне обонятельной системы в тканях, лишенных Gα olf 20 . Способность OR51E2 передавать физиологические сигналы через Gαs, в сочетании с наличием нанотела (Nb35), которое стабилизирует комплексы GPCR-Gα s 26 , побудили нас сосредоточиться на очистке комплекса OR51E2-G s . Для этого мы создали конструкцию OR51E2 с белком «miniGas», слитым с С- конца . Белок miniGas сконструирован для улавливания конформации Ga s , взаимодействующей с рецептором , в отсутствие каких-либо гуаниновых нуклеотидов 27 . Слияние miniGs с OR51E2 полностью блокировало стимулированную пропионатом передачу сигналов цАМФ в клетках HEK293T ( дополнительная рис. 2b ). Мы предположили, что miniGαs плотно взаимодействует с ядром 7TM OR51E2, чтобы предотвратить эндогенный Ga.связывание и производство цАМФ.
Мы очистили OR51E2-miniG в присутствии 30 мМ пропионата, а затем дополнительно создали комплекс с рекомбинантно очищенными Gβ 1 γ 2 и Nb35 ( дополнительные рис. 2a и c ). Полученный препарат был витрифицирован и проанализирован с помощью криогенной электронной микроскопии отдельных частиц (крио-ЭМ) ( дополнительный рисунок 3 и дополнительная таблица 1 ), которая дала карту OR51E2, связанного с гетеротримером G s , с разрешением 3,1 Å . Мы дополнительно создали карту с целенаправленным уточнением только для домена 7TM OR51E2, что обеспечило улучшенное разрешение карты сайта связывания и внеклеточных петель рецептора ( дополнительная рис. 3e).). Полученные реконструкции позволили нам смоделировать домен 7TM OR51E2, пропионатный лиганд и гетеротример Gs ( рис . 1c, d и дополнительные рис. 4a-c ).
Карман с отдушкой Мы определили плотность крио-ЭМ для пропионата в области, ограниченной трансмембранными спиралями (ТМ) 3, 4, 5 и 6 в OR51E2 ( рис. 2а и дополнительные рис. 4b, d ). Карман связывания одоранта пропионата в OR51E2 находится в той же общей области, что и карманы связывания лиганда в двух прототипах GPCR класса A: сайт связывания адреналина в β2-адренергическом рецепторе (β2-AR) 28 и полностью транс-ретиналь в родопсине 29 ( рис . 2а–в). По сравнению с β2-AR и родопсином карман связывания запаха в OR51E2 меньше и не взаимодействует с TM2 и TM7. Обширная упаковка N-конца OR51E2 с внеклеточными петлями 1 и 2 (ECL1 и ECL2) уменьшает потенциальный размер кармана для связывания запаха. Примечательно, что в отличие от многих GPCR класса А с диффундирующими агонистами карман связывания пропионата полностью окклюзирован внеклеточной средой ( рис. 2d ).
Фигура 2. Скачать рисунокОткрыть в новой вкладке Фигура 2. Карман с отдушкой из OR51E2. Сравнение сайта связывания пропионата в OR51E2 ( а ) с двумя другими прототипами GPCR класса А, β2-адренергическим рецептором (β2AR), связанным с адреналином (PDB 4LDO) 28 ( b ), и родопсином, связанным с полностью транс-ретиналем (PDB 6FUF) 29 ( с ). Пропионат в первую очередь связывается с TM4, TM5, TM6 и ECL2. Напротив, адреналин и all-trans сетчатка образуют более обширные контакты с другими трансмембранными спиралями GPCR. г ) Сайт связывания пропионата в активном OR51E2 закрыт от внеклеточного растворителя. д ) Крупный план сайта связывания пропионата в OR51E2. ф) Моментальные снимки молекулярно-динамического моделирования OR51E2, связанного с пропионатом, показаны в виде прозрачных палочек и наложены на структуру крио-ЭМ. R262 6,59 постоянно контактирует с пропионатом в течение 1000 нс времени моделирования (см. Дополнительный рисунок 8 для повторов моделирования). Показано минимальное расстояние между любым из атомов азота боковой цепи R262 6,59 и кислородом пропионата. g ) Тепловая карта контактных частот взаимодействия между остатками сайта связывания OR51E2 и атомами пропионата (как помечено в (f)), полученная из пяти независимых молекулярно-динамических симуляций, каждое продолжительностью 1 мкс (общее время 5 мкс). Частота среза контакта между остатком рецептора и атомами лиганда была установлена на уровне 40%. час) Анализ аланинового мутагенеза остатков, контактирующих с пропионатом, в OR51E2 с использованием анализа концентрации цАМФ в режиме реального времени. Точки данных представляют собой среднее значение ± стандартное отклонение от n = 3 экспериментов.
Пропионат образует несколько контактов внутри кармана связывания отдушки OR51E2. Карбоновая кислота пропионата взаимодействует с R262 6,59 (цифры в верхнем индексе указывают на консервативную нумерацию Баллестероса-Вайнштейна для GPCR 30 , 31 ) в TM6 в качестве противоиона. Та же самая пропионатная функциональная группа также участвует во взаимодействиях водородных связей с S258 6,55 и Q181 в ECL2 ( рис. 2e ). Мы использовали моделирование молекулярной динамики (МД), чтобы понять, являются ли эти взаимодействия стабильными. Мы выполнили пять 1 мкс моделирования OR51E2, связанного с пропионатом, но в отсутствие гетеротримера Gs . Во время этих симуляций мы наблюдали, что карбоксильная группа пропионата образует постоянное взаимодействие с R262.6,59 , со средним расстоянием, идентичным наблюдаемому в крио-ЭМ структуре ( рис. 2f и дополнительный рис. 5 ). Моделирование также подтвердило постоянные взаимодействия между карбоксильной группой пропионата и S258 6,55 с дополнительными контактирующими остатками, показанными на рис. 2g . Действительно, мутации аланина для этих остатков, координирующих карбоксильную группу, за исключением Q181 ECL2 , отменяют индуцируемую пропионатом активацию OR51E2 ( фиг. 2h ).
Ван-дер-ваальсовы контакты между алифатической группой пропионата и OR51E2 регулируются тесными упаковочными взаимодействиями. Алифатическая часть пропионата контактирует с остатками в TM3 (H104 3,33 ), TM4 (F155 4,57 и L158 4,60 ) и TM5 (G198 5,39 и I202 5,43 ). В отличие от постоянных контактов, наблюдаемых для атомов кислорода в группе карбоновой кислоты, взаимодействия между конкретными атомами углерода пропионата и алифатическими остатками в OR51E2 были более динамичными при моделировании ( рис. 2g ) и показали минимальный контакт с F155 4,57 . Однако мутации аланина в G198 5,39 , I202 5,43 и H104 3,33значительно снизила активность пропионата в OR51E2, предполагая, что существуют специфические пространственные требования к пропионату для связывания и активации рецептора. Напротив, пропионат лишь умеренно менее эффективен в отношении OR51E2 с мутацией L158 4,60 A ( рис. 2h ), вероятно, потому, что этот остаток взаимодействует только с дистальным углеродом Cγ пропионата. Таким образом, OR51E2 распознает пропионат со специфическими взаимодействиями ионных и водородных связей в сочетании с более распределенными ван-дер-ваальсовыми взаимодействиями с жесткой комплементарностью формы.
Настройка селективности обонятельных рецепторов Многие ОР способны реагировать на широкий спектр химически различных одорантов 2 , 18 . OR класса I, напротив, обычно более ограничены одорантами карбоновой кислоты 32 . Мы проверили селективность одорантов жирных кислот с различной длиной цепи в отношении OR51E2, чтобы понять, как структурные особенности рецептора приводят к специфичности запаха. В соответствии с предыдущими отчетами 23 , 33 мы определили, что ацетат (C2) и пропионат (C3) активируют OR51E2 с миллимолярной активностью ( Fig. 3a,b ). Напротив, жирные кислоты с более длинной цепью (C4-C10) были либо слабо активны, либо не активны при OR51E2.
Рисунок 3. Скачать рисунокОткрыть в новой вкладке Рисунок 3. Настройка избирательности одоранта OR51E2. а, б) OR51E2 избирательно реагирует на ацетат и пропионат короткоцепочечных жирных кислот, что измеряется с помощью анализа продукции цАМФ. c) Крупный план кармана для креплений OR51E2, полость кармана для креплений показана серой поверхностью. Предполагается , что замена F155 4,57 и L158 4,60 аланином приводит к образованию связывающего кармана с увеличенным объемом, способного вместить жирную кислоту с более длинной цепью. Состыкованные позы октаноата (С8) и гексаноата (С6) показаны у мутантов F155A и L158A OR51E2 соответственно. г)Мутации F155A и L158A в OR51E2 приводят к повышенной чувствительности к длинноцепочечным жирным кислотам. И наоборот, активность ацетата и пропионата у этих двух мутантов снижена. Точки данных в b и d представляют собой среднее значение ± стандартное отклонение от n = 4 экспериментов.
Мы предположили, что селективность OR51E2 в отношении жирных кислот с короткой цепью возникает из-за ограниченного объема окклюзированного кармана связывания (31 Å 3 ), который может вмещать жирные кислоты с короткой цепью, такие как ацетат и пропионат, но препятствует связыванию жирных кислот с более длинной алифатической цепью. длины ( рис. 3в ). Поэтому мы предположили, что объем кармана связывания действует как детерминант селективности в отношении длины цепи жирной кислоты. Чтобы непосредственно проверить эту гипотезу, мы разработали две мутации, которые, по прогнозам, приведут к увеличению объема кармана связывания при сохранении специфических контактов с R262 6,59 , важных для активации жирными кислотами OR51E2. Более конкретно, мы мутировали два остатка, расположенных проксимальнее углеродной цепи пропионата: F155.4,57 и L158 4,60 . Компьютерное моделирование мутаций F155 4,57 A и L158 4,60 A предсказало объемы карманов 90 Å 3 и 68 Å 3 соответственно, предполагая, что оба мутанта должны в достаточной степени вмещать жирные кислоты с более длинной цепью ( Fig. 3c ). Действительно, в анализах цАМФ мутанты F155 4,57 A и L158 4,60 A OR51E2 в целом реагировали на жирные кислоты с более длинной цепью ( рис. 3d , дополнительные таблицы 2 и 3) .). Размер каждого связывающего кармана коррелировал с максимально допустимой длиной цепи и, кроме того, с тем, какая длина цепи имеет наибольшую эффективность. Например, F155 4,57 A чувствителен к ряду жирных кислот (C2-C9), при этом октаноат (C8) проявляет максимальную активность и эффективность. Напротив, гексаноат (C6) является наиболее эффективным агонистом мутанта L158 4,60 A. Для обеих этих мутаций активность ацетата и пропионата снижена по сравнению с OR51E2, что указывает на то, что взаимодействия плотной упаковки с алифатической цепью являются важным фактором, определяющим активность агониста.
Затем мы исследовали консервативность остатков, определяющих селективность, в ОР человека как класса I, так и класса II. Отражая его важность в распознавании жирных кислот, аргинин высоко консервативен в положении 6,59 в большинстве OR класса I человека (класс I 71% против класса II 7%) ( дополнительная рис. 6 ). Положения 4,57 и 4,60 во всех OR класса I человека ограничены алифатическими аминокислотами разного размера (V/I/L/M/F, класс I >80% по сравнению с классом II <15%). Напротив, ни одна из этих позиций не имеет подобных ограничений в операционных классах II. Мы предполагаем, что сохраняющийся остаток R 6,59могут закреплять одоранты во многих связывающих карманах OR класса I, в то время как разнообразие в положениях 4,57 и 4,60 настраивает связывающий карман, чтобы обеспечить избирательное распознавание остатка молекулы. Таким образом, две особенности могут управлять распознаванием одорантов для ОР класса I: 1) водородные связи или ионные взаимодействия, которые закрепляют полярные свойства одорантов с консервативными остатками связывающего кармана ОР, и 2) ван-дер-ваальсовы взаимодействия различных алифатических остатков в связывающем кармане ОР, которые определяют закрытый объем, имеющий геометрию, которая точно соответствует форме родственных одорантов.
Механизмы активации OR51E2 Предполагается, что связывание пахучих веществ с OR вызывает конформационные изменения в рецепторе, которые позволяют задействовать G-белок. Наша стратегия по стабилизации OR51E2 с помощью miniG препятствовала определению структуры неактивного OR51E2 в отсутствие одоранта. Поэтому мы обратились к сравнительному структурному моделированию, исследованиям мутагенеза и моделированию молекулярной динамики, чтобы понять влияние связывания пропионата на конформацию OR51E2.
Сравнение активного OR51E2 с G s -связанным активным состоянием β2-адренергического рецептора (β2-AR) продемонстрировало, что оба рецептора взаимодействуют с белком G с аналогичной общей ориентацией домена 7TM и Gα s ( рис. 4a и дополнительная рис. 7). ). Центральным признаком активации GPCR является смещение наружу TM6 на цитоплазматической стороне рецептора, которое сопровождается более тонким движением других спиралей TM 34.. Эти конформационные изменения создают полость для C-концевой α-спирали G-белка. Предыдущие исследования в области структурной биологии выявили две области, консервативные в GPCR класса A, которые критически важны для аллостерической связи между сайтом связывания агониста и сайтом связывания G-белка: соединительная область, примыкающая к сайту связывания лиганда, и область связывания G-белка. области, примыкающей к С-концевой α-спирали 34 Gaαs ( рис . 4а ).). Мы стремились понять, как связывание пропионата с OR51E2 стабилизирует эти области в активной конформации. Хотя общая конформация OR51E2 и β2-AR аналогична (среднеквадратичное отклонение (RMSD) 3,2 Å), специфические последовательности, которые определяют связывающие G-белок и соединительные области, различаются между OR и не обонятельными классами A. GPCR. Сравнение консервативности последовательности в TM6 между OR человека и не обонятельными GPCR класса A выявило высококонсервативный мотив (KAFSTCxSH 6.40 ) в области связывания G-белка в OR, который отсутствует в не обонятельных рецепторах ( Fig. 4b ). Напротив, высококонсервативный мотив CWxP 6.50 в соединительной области GPCR класса A отсутствует в OR. Вместо этого OR содержат ранее описанный FYGx6.50 мотив в соединительной области 35 ( рис. 4f,g ).
Рисунок 4. Скачать рисунокОткрыть в новой вкладке Рисунок 4. Механизм активации OR51E2. а) Ленточная диаграмма, сравнивающая структуры комплекса OR51E2- miniGs, связанного с пропионатом (зеленый), и комплекса β2AR-Gs, связанного с BI-167107 (синий, PDB 3SN6 ) . Для обоих рецепторов соединительная область связывает конформационные изменения в месте связывания лиганда с областью связывания G-белка. b) Weblogo, изображающее сохранение трансмембранной спирали 6 аминокислот либо в обонятельных рецепторах человека, либо в не обонятельных GPCR класса A человека. Указана нумерация аминокислот для OR51E2 и Ballosteros-Weinsten (BW). Крупный план домена, связывающего G-белок, в активном OR51E2 ( c ) , а также в активном и неактивном β2AR ( d ). Активация β2AR связана с движением внутрь TM7 и контактом между Y2195,58 и Y326 7,53 . В OR51E2, напротив, H243 6.40 взаимодействует с Y217 5.58 в активном состоянии. e ) Анализ аланинового мутагенеза остатков домена, связывающего G-белок, в OR51E2 с использованием анализа концентрации цАМФ в режиме реального времени. Крупный план соединительной области в активном OR51E2 ( f) , а также в активном и неактивном β2AR ( g ). h ) Анализ мутагенеза остатков соединительной области в OR51E2 с использованием анализа концентрации цАМФ в режиме реального времени. я) Моментальные снимки молекулярно-динамического (МД) моделирования OR51E2 с удаленным пропионатом. Моделирование показывает повышенную гибкость TM6 в остатках соединительной области. Молекулярно-динамические траектории для репрезентативных симуляций, показывающих угол поворота ротамера боковой цепи F250 6,47 ( j ) и расстояние между гидроксильными группами S111 3,40 и Y251 6,48 ( k ), выполненные с пропионатом или без него в течение 1000 нс MD-моделирования (см. 8 для имитационных повторов). Точки данных в e и h означают ± стандартное отклонение от n = 4 экспериментов.
Более тщательное изучение области связывания G-белка в OR51E2 выявило уникальную сеть водородных связей между высококонсервативными остатками R121 3,50 в TM3, H243 6,40 в TM6 и Y217 5,58 в TM5, которая не наблюдается в других GPCR класса A ( рис. 4c, d). ). Активация β2-AR связана с внутренним движением TM7, которое позиционирует Y316 7,53 в пределах опосредованного водой расстояния водородных связей Y219 5,58 ; это движение приводит к движению ТМ6 наружу за счет вытеснения алифатического остатка I278 6.40 ( рис. 4d ). Учитывая высокое сохранение R 3,50 , H 6,40 и Y 5,58во всех OR (89%, 97% и 93% соответственно, дополнительная рис. 7 ) мы предполагаем, что этот контакт важен для стабилизации активной конформации OR. Действительно, аланиновый мутагенез остатков OR51E2 в области связывания G-белка демонстрирует резкую потерю активности для H243 6,40 , Y217 5,58 и R121 3,50 , связанную с плохой экспрессией рецептора ( рис. 4e и дополнительная таблица 2 ). Мутация Y291 7.53 в OR51E2, напротив, оказывает более скромное влияние на активность пропионата.
Затем мы исследовали соединительную область OR51E2, непосредственно примыкающую к сайту связывания пропионата ( рис. 4f ). Активация β2-AR связана с перестройкой мотива PIF между позициями I 3.40 (TM3), P 5.50 (TM5) и F 6.44 (TM6), что приводит к смещению TM6 наружу. Это скоординированное движение наблюдалось для большинства GPCR класса A, для которых были получены структуры как активного, так и неактивного состояния 34 . Консервация в положениях PIF низкая в OR, что предполагает альтернативный механизм. В OR51E2 мы наблюдаем протяженную сеть водородных связей между Y251 6,48 специфического для OR мотива FYGx и остатками в TM3 (S111 3,40), TM4 (R150 4,52 ) и TM5 (D209 5,50 ). Примечательно, что внутримембранное ионное взаимодействие между D209 5,50 и R150 4,52 , вероятно, сохраняется только в OR класса I (класс I: D 5,50 -82%, R 4,52 -88%, класс II: D 5,50 -0,3%, R 4,52 -0% , Дополнительный рис. 7 ). Аланиновый мутагенез большинства остатков в этой соединительной области OR51E2 устраняет реакцию на пропионат ( рис. 4h ), отчасти потому, что мутации в этой области резко снижают экспрессию рецептора ( дополнительная таблица 2 ). Более консервативные замены F250 6,47 или Y251 6,48также обнаруживают нарушение функции OR51E2, предполагая, что специфические контакты, наблюдаемые в активном OR51E2, важны для надежной активации рецептора.
Мы обратились к моделированию молекулярной динамики, чтобы изучить, как связывание лиганда влияет на конформацию соединительной области. После удаления G-белка мы смоделировали OR51E2 с пропионатом и без него в сайте связывания. Для каждого условия мы выполнили пять симуляций по 1 мкс. OR51E2, смоделированный пропионатом, остается в конформации, аналогичной структуре крио-ЭМ. В отсутствие пропионата соединительная область OR51E2 демонстрирует значительно большую гибкость при моделировании ( рис. 4i и дополнительная рис. 8 ). Мы наблюдали два движения в мотиве FYGx, связанные с этой повышенной конформационной гетерогенностью: ротамерная гибкость F250 6,47.между экспериментально наблюдаемой конформацией и альтернативными ротамерами и нарушением водородной связи между Y251 6,48 и S111 3,40 ( рис. 4j,k и дополнительная рис. 8 ). Моделирование без пропионата показывает, что расстояние между гидроксильными группами Y251 6,48 и S111 3,40 составляет >4 Å, что указывает на потерю водородной связи, наблюдаемую как в крио-ЭМ-структуре OR51E2, так и в МД-моделировании с пропионатом (рис . 4k и дополнительный рис. 8). Основываясь на структурном сравнении с другими GPCR класса A, исследованиях мутагенеза и моделировании молекулярной динамики, мы поэтому предполагаем, что связывание одоранта стабилизирует конформацию мотива FYGx, который в противном случае был бы динамичным, чтобы управлять активацией OR.
Структурная динамика ECL3 в функции ИЛИ Обонятельные рецепторы обнаруживают значительную изменчивость последовательности во внеклеточной петле 3 (ECL3), области, которая, как ранее было показано, является критической для распознавания весьма разнообразных одорантов 36 , 37 . Поэтому мы стремились понять участие ECL3 в связывании пропионата с OR51E2 и, в более общем плане, как ECL3 может управлять конформационными изменениями в TM6, необходимыми для активации OR ( рис. 5 ). В нашей структуре OR51E2 ECL3 напрямую связан со связыванием одоранта посредством прямого взаимодействия между остатком карбоновой кислоты пропионата и соседним остатком ECL3 R262 6,59 ( рис. 5a ). Чтобы исследовать роль R262 6.59при сохранении конформации ECL3 путем связывания одоранта мы проанализировали моделирование OR51E2, выполненное без пропионата. В отсутствие координации с карбоксильной группой пропионата R262 6,59 показал заметное увеличение гибкости с перемещением наружу до 8 Å от места связывания лиганда ( рис. 5b и c ). Это движение сопровождается смещением ECL3 из кармана связывания одоранта.
Рисунок 5: Скачать рисунокОткрыть в новой вкладке Рисунок 5: Структурная динамика ECL3 в функции ИЛИ. а) Остаток R262 6,59 в ECL3 вступает в критический контакт с пропионатом. Остаток Q181 ECL2 в ECL2 выделен. b) Моментальные снимки молекулярной динамики OR51E2, смоделированные в отсутствие пропионата, показывают повышенную гибкость R262 6,59 . c) При моделировании OR51E2 дикого типа (WT), связанного с пропионатом, расстояние между R262 6,59 и G198 5,39 стабильно и похоже на структуру крио-ЭМ. Моделирование WT OR51E2 без пропионата (без лиганда) показывает увеличенные расстояния между R262 6,59 и G198 5,39 . При моделировании мутанта Q181D без пропионата расстояние между R262 6,59и G198 5,39 похож на WT OR51E2, связанный с пропионатом. Расстояние было измерено между атомами боковой цепи R262 6,59 и атомами основной цепи G198 5,39 (исключая атомы водорода) в течение 1000 нс моделирования MD (см. дополнительный рисунок 8 для повторов моделирования). d) Консервативный мутагенез Q181 ECL2 показывает, что мутант Q181D конститутивно активен, возможно, потому, что он заменяет карбоновую кислоту в кармане связывания OR51E2. e) Сравнение крио-ЭМ структуры OR51E2 с предсказанной AlphaFold2 структурой показывает высокое сходство во внеклеточном домене, за исключением области ECL3. Модель AlphaFold2 имеет внешнее смещение R262 6,59.и ECL3 аналогичны имитациям апо OR51E2. f) предсказания AlphaFold2 для всех обонятельных рецепторов человека показывают низкую достоверность в области ECL3 и высокую достоверность в других внеклеточных петлях. g) Модель ECL3 как ключевого сайта для активации обонятельных рецепторов.
Чтобы проверить, достаточно ли внутреннего движения R262 6.59 для активации OR51E2, мы разработали эксперимент с усилением функции. Мы предположили, что введение кислотного остатка в связывающий карман соответствующей геометрии может заменить карбоновую кислоту пропионата и координировать R262 6,59 . Действительно, замена Asp в положении 181 (Q181D) OR51E2 приводила к увеличению базовой активности цАМФ ( фиг. 5d ). Напротив, введение Glu в то же самое положение (Q181E) делало OR51E2 в значительной степени неактивным, указывая на необходимость точной координационной геометрии для R262 6,59 . Замена на более крупный Gln (Q181N) сделала OR51E2 полностью нечувствительным к пропионату либо за счет стерической блокировки R262 6,59или путем замены самого пропионата. При моделировании OR51E2 с заменой Q181D R262 6,59 постоянно взаимодействует с сайтом связывания лиганда ( Fig. 5b ). Кроме того, это движение внутрь R262 6.59 и ECL3 сопровождается связанными с активацией конформационными изменениями в соединительном домене OR51E2 ( дополнительная рис. 9 ), что, возможно, объясняет базовую активность мутанта Q181D. Таким образом, внутреннего движения ECL3 достаточно для активации OR51E2.
Поскольку конформационные изменения в ECL3 имеют решающее значение для активации OR51E2, мы предположили, что эта область может обеспечивать общий механизм активации для всего семейства OR. Чтобы проверить это понятие, мы изучили предсказания структуры всех человеческих обонятельных рецепторов с помощью AlphaFold2 38 . Сначала мы сравнили предсказание AlphaFold2 для OR51E2 со структурой крио-ЭМ, что дало высокую степень согласия, отраженную в среднеквадратичном отклонении 1,3 Å для атомов Cα. Важно отметить, что предсказанная AlphaFold2 структура OR51E2, по-видимому, находится в промежуточной или неактивной конформации, характеризующейся смещением наружу R262 6,59 и ECL3, домена, связывающего G-белок, в неактивной конформации, а TM6 расположен более внутрь по сравнению с активным OR51E2 ( рис. 5e) . иДополнительный рис. 10 ). Затем мы исследовали предсказанные структуры всех человеческих OR, которые выявили в значительной степени общую топологию внеклеточной области для более широкого семейства ( Fig. 5f ). Действительно, оценка достоверности для каждого остатка из AlphaFold2 (прогнозируемая локальная разность расстояний, pLDDT) для N-конца, ECL1 и ECL2 прогнозируется с высокой достоверностью для большинства OR. Напротив, ECL3 показывает значительно более низкие оценки pLDDT. Поскольку низкие показатели pLDDT коррелируют с неупорядоченными областями белка 38, мы предполагаем, что в отсутствие связывания запаха структура ECL3 менее ограничена по сравнению с остальной частью кармана связывания запаха для более широкого семейства OR. Таким образом, подобно OR51E2, связывание одоранта может стабилизировать ECL3, чтобы активировать рецептор для более широкого семейства OR.
Обсуждение Мы предлагаем следующую модель активации OR51E2 ( рис. 5g ). В несвязанном состоянии внеклеточный сегмент TM6 является динамичным. При связывании пропионата TM6 поворачивается внутрь к домену 7TM и стабилизируется посредством прямой координации пропионаткарбоновой кислоты через R262 6,59. Консервативный мотив FYGx в TM6 действует как структурная точка поворота, вокруг которой вращается TM6, чтобы вытеснить внутриклеточный конец TM6 из ядра TM и открыть канонический сайт связывания активного G-белка. Хотя специфические взаимодействия между пропионатной алифатической цепью и остатками в сайте связывания важны для достижения полной эффективности одорантной реакции, OR51E2 конститутивно активен, когда остаток аспартата (Q181D) вводится в карман связывания. Это говорит о том, что наблюдаемое вращение TM6, опосредованное координацией R262 со стабильной анионной группой в сайте связывания, само по себе достаточно для активации рецептора. Хотя эта модель остается спекулятивной из-за отсутствия экспериментально определенной структуры OR51E2 в неактивном состоянии, он объединяет результаты уникальных структурных особенностей OR по сравнению с другими GPCR класса A, моделирования молекулярной динамики и исследований мутагенеза. Подобный механизм может быть ответственен за активацию большинства OR класса I, подавляющее большинство которых распознает карбоновые кислоты и содержит аргинин в положении 6,59. Механизм активации OR класса II, которые распознают более широкий спектр летучих одорантов и не имеют R.6.59 , может быть потенциально отличным.
bARyon_©°ჼTinum_bA℞gAwvelid3E [Men'de'Lёvi'$ TblI©I .©h_Э€_ßёrnÅвАкеЯАdД]
Наша работа освещает молекулярные основы распознавания запахов у позвоночных класса I OR. В то время как весь спектр потенциальных одорантов, которые активируют OR51E2, еще предстоит охарактеризовать, профилирование известных одорантов жирных кислот предполагает, что OR51E2 узко настроен на жирные кислоты с короткой цепью 18 , 23 .. Пропионат связывает OR51E2 с помощью двух типов взаимодействий - специфических взаимодействий ионов и водородных связей, которые закрепляют карбоновую кислоту, и более неспецифических гидрофобных контактов, которые основаны на комплементарности формы с алифатической частью лиганда. Мы показываем, что определенные геометрические ограничения, налагаемые закрытым карманом связывания одоранта OR51E2, частично ответственны за эту селективность. Таким образом, молекулярное распознавание в OR51E2 отличается от распределенных гидрофобных взаимодействий, которые опосредуют распознавание запаха в ионном канале, управляемом насекомыми 11.. Мы ожидаем, что молекулярный механизм, который мы определяем здесь для OR51E2, вероятно, будет распространяться на другие OR класса I, которые распознают полярные водорастворимые одоранты с несколькими акцепторами и донорами водородных связей. Однако молекулярное распознавание более широко настроенными ОР и большим семейством ОР класса II еще предстоит определить.
Структурная основа распознавания лиганда для OR51E2 также дает представление об эволюции семейства OR. В отличие от большинства генов OR позвоночных, которые быстро эволюционировали за счет дупликации и диверсификации генов, OR51E2 является одним из немногих OR с сильной эволюционной консервативностью у разных видов 5. Это ограничение может быть результатом признания одорантов, важных для выживания, или жизненно важной необонятельной роли активности OR51E2, обнаруживающей пропионат и ацетат, основные метаболиты, продуцируемые кишечной микробиотой. Таким образом, молекулярное распознавание пропионата с помощью OR51E2 может представлять собой уникальный пример специфичности в более широком семействе OR. В то время как будущая работа продолжит расшифровку того, как сотни OR ощущают чрезвычайно большое разнообразие запахов, наша структура и механистическое понимание функции OR51E2 обеспечивают новую основу для понимания нашего обоняния на атомном уровне.
МЕТОДЫ Экспрессия и очистка белка OR51E2- miniGs Человеческий OR51E2 был клонирован в pCDNA-Zeo-TetO, специальный вектор pcDNA3.1, содержащий тетрациклин-индуцируемую кассету экспрессии генов 41 . Конструкция включала N-концевую сигнальную последовательность гемагглютинина вируса гриппа и эпитопную метку FLAG (DYKDDDK). Конструкция дополнительно включала белок miniG s399 5 , который был слит с С-концом OR51E2 с последовательностью расщепления протеазой риновируса человека 3C (HRV 3C), фланкированной линкерами Gly-Ser.
Полученную конструкцию (OR51E2-miniG s399 ) трансфицировали в 1 л индуцируемых клеток Expi293F-TetR (неаутентифицированных и непроверенных на загрязнение микоплазмой, Thermo Fisher) с использованием набора для трансфекции ExpiFectamine 293 (Thermo Fisher) в соответствии с инструкциями производителя. Через 16 часов экспрессию белка индуцировали 1 мкг/мл доксициклина гиклата (Sigma Aldrich) и культуру помещали в инкубатор с встряхиванием, поддерживая 37°C и атмосферу с 5% CO 2 . Через 36 часов клетки собирали центрифугированием и хранили при -80°С.
Для очистки рецепторов клетки размораживали и гипотонически лизировали в 50 мМ HEPES, pH 7,50, 1 мМ ЭДТА, 30 мМ пропионата натрия (Sigma Aldrich), 100 мкМ трис(2-карбоксиэтил)фосфина (TCEP, Fischer Scientific), 160 мкг/л. мл бензамидина, 2 мкг/мл лейпептина в течение 15 минут при 4°С. Лизированные клетки собирали центрифугированием при 16000×g в течение 15 минут и немедленно гомогенизировали в охлажденном льдом буфере для солюбилизации, содержащем 50 мМ HEPES, pH 7,50, 300 мМ NaCl, 1% (мас./об.) лаурилмальтозы, неопентилгликоля (L- MNG, Anatrace), 0,1% (масса/объем) гемисукцината холестерина (CHS, Steraloids), 30 мМ пропионата натрия, 5 мМ аденозин-5'-трифосфата (АТФ, Fischer Scientific), 2 мМ MgCl2, 100 мкМ TCEP, 160 мкг/ мл бензамидина и 2 мкг/мл лейпептина. Пробу перемешивали в течение 2 ч при 4°С, фракцию, растворенную в детергенте, осветляли центрифугированием при 20°С. 000 хг за 30 мин. Образец, растворенный в детергенте, был дополнен 4 мМ CaCl.2 , и инкубировали в партии с самодельной конъюгированной M1-FLAG-антитело CNBr-сефарозой при медленном вращении в течение 1,5 часов при 4°C. Сефарозную смолу переносили в стеклянную колонку и промывали 20 объемами колонки ледяного буфера, содержащего 50 мМ HEPES, pH 7,50, 300 мМ NaCl, 0,05% (масса/объем) L-MNG, 0,005% (масса/объем) CHS. , 30 мМ пропионата натрия, 2,5 мМ АТФ, 4 мМ CaCl 2 , 2 мМ MgCl2 и 100 мкМ TCEP. За этим последовали 10 объемов колонки охлажденного льдом 50 мМ HEPES, pH 7,50, 150 мМ NaCl, 0,0075% (масса/объем) L-MNG, 0,0025% гликодиосгенина (GDN, Anatrace), 0,001% (масса/объем) ) CHS, 30 мМ пропионат натрия, 4 мМ CaCl 2и 100 мкМ TCEP. Фракции, содержащие рецептор, элюировали охлажденным льдом 50 мМ HEPES, pH 7,50, 150 мМ NaCl, 0,0075% (масса/объем) L-MNG, 0,0025% (масса/объем) GDN, 0,001% (масса/объем) CHS, 30 мМ пропионат натрия, 5 мМ ЭДТА, 100 мкМ TCEP и 0,2 мг/мл пептида FLAG. Фракции, содержащие слитый белок OR51E2-miniG s399 , концентрировали на спин-фильтре MWCO 50 кДа (Amicon) и дополнительно очищали на колонке для эксклюзионной хроматографии (SEC) Superdex 200 Увеличить 10/300 GL (Cytiva), которую уравновешивали 20 мМ HEPES, pH 7,50, 150 мМ NaCl, 0,005% (масса/объем) GDN и 0,0005% CHS, 30 мМ пропионат натрия и 100 мкМ TCEP. Фракции, содержащие монодисперсный OR51E2-miniG s399 , объединяли и концентрировали на центрифужном фильтре с MWCO 50 кДа перед комплексообразованием с Gβ 1 γ 2и Кb35.
Экспрессия и очистка Gβ 1 γ 2 Бакуловирус был создан с вектором экспрессии pVLDual, кодирующим как субъединицу Gβ 1 человека с расщепляемой N-концевой 6x His-меткой HRV 3C, так и немеченую субъединицу Gγ 2 человека в клетках насекомых Spodoptera frugiperda Sf9 (непроверенных и непроверенных на заражение микоплазмой, Системы экспрессии). Для экспрессии клетки насекомых Trichoplusia ni Hi5 (неаутентифицированные и непроверенные на заражение микоплазмой, Expression Systems) инфицировали при плотности 3,0 x 10 6 клеток/мл высоким титром Gβ 1 γ 2-baculovirus и выращивали при 27°C при встряхивании со скоростью 130 об/мин. Через 48 часов клетки собирали и ресуспендировали в буфере для лизиса, содержащем 20 мМ HEPES, pH 8,00, 5 мМ β-меркаптоэтанола (β-ME), 20 мкг/мл лейпептина и 160 мкг/мл бензамидина. Лизированные клетки осаждали при 20 000×g в течение 15 минут и солюбилизировали 20 мМ HEPES pH 8,0, 100 мМ хлорида натрия, 1% (вес/объем) холата натрия (Sigma Aldrich), 0,05% (вес/объем) н-додецил- β-D-мальтопиранозид (DM, Anatrace) и 5 мМ β-меркаптоэтанол (β-ME). Солюбилизированный Gβ 1 γ 2 осветляли центрифугированием при 20000×g в течение 30 минут, а затем инкубировали порциями со смолой HisPur Ni-NTA (Thermo Scientific). Связанный смолой Gβ 1 γ 2тщательно промывали перед тем, как детергент медленно заменяли в колонке на 0,1% (масса/объем) L-MNG и 0,01% (масса/объем) CHS. Gβ 1 γ 2 элюировали 20 мМ HEPES pH 7,50, 100 мМ NaCl, 0,1% (масса/объем) L-MNG, 0,01% (масса/объем) CHS, 300 мМ имидазол, 1 мМ DL-дитиотреитол (ДТТ), 20 мкг/мл лейпептина и 160 мкг/мл бензамидина. Фракции, содержащие Gβ 1 γ 2 , объединяли и дополняли протеазой 3C собственного производства перед ночным диализом в буфере, содержащем 20 мМ HEPES, pH 7,50, 100 мМ NaCl, 0,02% (масса/объем) L-MNG, 0,002% (масса/объем) CHS. , 1 мМ ДТТ и 10 мМ имидазола. Нерасщепленный Gβ 1 γ 2 удаляли периодической инкубацией со смолой Ni-NTA, прежде чем несвязанную фракцию, содержащую расщепленный Gβ 1 γ2 дефосфорилировали обработкой лямбда-фосфатазой (New England Biolabs), кишечной фосфатазой теленка (New England Biolabs) и антарктической фосфатазой (New England Biolabs) в течение 1 часа при 4°C. Геранилгеранилированный гетеродимер Gβ 1 γ 2 выделяли с помощью анионообменной хроматографии с использованием колонки MonoQ 4,6/100 PE (Cytiva) перед ночным диализом в 20 мМ HEPES, pH 7,50, 100 мМ NaCl, 0,02% (масса/объем) L-MNG, и 100 мкМ TCEP. Конечный образец концентрировали на центрифужном фильтре MWCO 3 кДа (Amicon) и добавляли 20% (об./об.) глицерина перед мгновенной заморозкой в жидком N 2 для хранения при -80°С.
Экспрессия и очистка Nb35 ДНК, кодирующую Nb35 (описанную Rasmussen et al. 6 ), клонировали в модифицированный вектор экспрессии pET-26b, содержащий C-концевую His-метку, за которой следует аффинная метка белка C (EDQVDPRLIDGK). Полученную ДНК трансформировали в компетентную Rosetta2 (DE3) pLysS Escherichia coli (UC Berkeley QB3 MacroLab) и инокулировали в 100 мл бульона Луриа с добавлением 50 мкг/мл канамицина, который культивировали в течение ночи при встряхивании со скоростью 220 об/мин при 37°C. На следующий день заквасочную культуру инокулировали в 8 х 1 л бульона Terrific с добавлением 0,1% (масса/объем) декстрозы, 2 мМ MgCl2 и 50 мкг/мл канамицина, которые затем культивировали при 37°C при встряхивании. Экспрессия Nb35 индуцировалась при OD 600.= 0,6, добавлением 400 мкМ изопропил-β-D-1-тиогалактопиранозида (IPTG, GoldBio) и снижением температуры инкубатора до 20°C. После 21 часа экспрессии клетки собирали центрифугированием и ресуспендировали в буфере SET, содержащем 200 мМ трис(гидроксиметил)аминометан (Tris, Sigma Aldrich), pH 8,00, 500 мМ сахарозы, 0,5 мМ ЭДТА, 20 мкг/мл лейпептина, 160 мкг/мл бензамидина и 1 ЕД бензоназы. После 30-минутного перемешивания при комнатной температуре инициировали гипотонический лизис путем 3-кратного разбавления деионизированной водой. После 30 минут перемешивания при комнатной температуре ионную силу доводили до 150 мМ NaCl, 2 мМ CaCl 2 и 2 мМ MgCl 2 .и лизат очищали центрифугированием при 20000 g в течение 30 мин. Очищенный лизат инкубировали в пакете с самодельным антителом против протеина С, связанным с CNBr-сефарозой, при медленном вращении. Смолу тщательно промывали буфером, содержащим 20 мМ HEPES, pH 7,50, 300 мМ NaCl и 2 мМ CaCl 2 , а Nb35 элюировали 20 мМ HEPES, pH 7,50, 100 мМ NaCl, 0,2 мг/мл пептида протеина C и 5 мМ ЭДТА. Фракции, содержащие Nb35, концентрировали на центрифужном фильтре MWCO 10 кДа (Amicon) и дополнительно очищали на колонке SEC Superdex S75 Увеличение 10/300 GL (Cytiva), уравновешенной 20 мМ HEPES, pH 7,50 и 100 мМ NaCl. Фракции, содержащие монодисперсный Nb35, концентрировали и дополняли 20% глицерином перед быстрой заморозкой в жидком N 2 для хранения при -80°С.
Получение комплекса OR51E2-G в активном состоянии Для получения комплекса OR51E2-Gs к SEC-очищенному OR51E2- miniGs399 добавляли 2-кратный молярный избыток очищенных Gβ 1 γ 2 и Nb35 с последующей инкубацией на льду в течение ночи. Образец концентрировали на центрифужном фильтре MWCO 50 кДа (Amicon) и вводили в колонку Superdex 200 Увеличить 10/300 GL SEC, уравновешенную 20 мМ HEPES, pH 7,50, 150 мМ NaCl, 0,0075% (масса/объем) L. -MNG, 0,0025% (масса/объем) GDN, 0,001% (масса/объем) CHS и 30 мМ пропионата натрия. Фракции, содержащие мономерный комплекс OR51E2-Gs, концентрировали на центрифужном фильтре MWCO 100 кДа непосредственно перед приготовлением крио-ЭМ сетки.
Крио-ЭМ витрификация, сбор и обработка данных 2,75 мкл очищенного комплекса OR51E2-G s наносили на пленки-подложки из золота R1.2/1.3 UltraAuFoil 300 меш, подвергнутые тлеющему разряду (Quantifoil). Пленки-подложки подвергали глубокой заморозке в жидком этане с использованием Vitrobot Mark IV (Thermo Fisher) с периодом выдержки 10 с, силой блоттинга, равной 0, и временем блоттинга, варьирующимся от 1 до 5 с, при поддержании 100% влажности и 4°C. Витрифицированные сетки зажимали с помощью держателей образцов Autogrid (Thermo Fisher) непосредственно перед визуализацией. Видеоролики OR51E2-G, погруженных в лед, были записаны с использованием Titan Krios Gi3 (Thermo Fisher) с фильтром биоквантовой энергии (Gatan) и детектором прямых электронов K3 (Gatan). Данные были собраны с помощью Serial EM 42.запуск шаблона сдвига изображения 3 x 3 при наклоне предметного столика 0°. Номинальное увеличение 105 000 x с объективом 100 мкм использовалось в режиме сверхвысокого разрешения с физическим размером пикселя 0,81 Å пиксель -1 . Видеоролики были записаны с использованием фракционированного освещения с общей экспозицией 50 e - Å -2 на 60 кадрах, что дало 0,833 e - Å -2 кадра -1 .
16 113 видеороликов со сверхвысоким разрешением были скорректированы по движению и обрезаны по Фурье до физического размера пикселя с помощью UCSF MotionCor2 43 . Взвешенные по дозе микрофотографии были импортированы в программу cryoSPARC v3.2 (Structura Biotechnology), а функции переноса контраста были рассчитаны с использованием инструмента Patch CTF Estimation. Пороговое разрешение подгонки CTF > 5 Å использовалось для исключения микрофотографий низкого качества. Частицы были выбраны шаблоном с использованием модели с фильтром нижних частот 20 Å, которая была создана ab initio.на основе данных, собранных во время предыдущего сеанса скрининга 200 кВ. 8 884 130 частиц были извлечены с размером окна 288 пикселей, объединены в бины до 72 пикселей и отсортированы с помощью инструмента Heterogeneous Refinement, который служил для 3D-классификации с выравниванием. Объемы шаблонов для каждого из четырех классов были отфильтрованы фильтром нижних частот до 20 Å и включали исходные OR51E2-G s.объем, а также три зашифрованных тома, полученные путем завершения работы инструмента Ab-Initio Reconstruction перед первой итерацией. Полученные 1 445 818 частиц были повторно извлечены с размером ячейки 288 пикселей, объединены в бины до 144 пикселей и отсортированы с помощью дополнительного раунда гетерогенного уточнения с использованием двух идентичных исходных моделей и двух скремблированных моделей. 776 527 частиц из реконструкции с самым высоким разрешением были извлечены с размером поля без бининга 288 пикселей и подвергнуты однородному уточнению, а затем неравномерному уточнению. Частицы были экспортированы с помощью csparc2star.py из пакета сценариев pyem v0.539 , а маска включения, покрывающая домен 7TM OR51E2, была сгенерирована с помощью инструмента Segger в UCSF ChimeraX44 .и инструмент mask.py в pyem v0.5. Частицы и маска были импортированы в Relion v3.0 45 и отсортированы по нескольким раундам 3D-классификации без выравнивания изображения, где количество классов и тау-фактор могли варьироваться. Полученные 204 438 частиц были возвращены в криоSPARC и подвергнуты неравномерному уточнению. Наконец, было выполнено локальное уточнение с использованием маски включения, охватывающей домен 7TM, с использованием гауссовых априорных значений позы/сдвига с SD величин вращения и сдвига, ограниченных 3° и 2 Å соответственно.
Построение и уточнение модели Построение и уточнение модели выполняли с использованием предсказанной структуры Alphafold2 38 в качестве исходной модели, которая была вписана в карту OR51E2-G s с использованием UCSF ChimeraX. Черновая модель была сгенерирована с использованием ISOLDE 46 и в дальнейшем усовершенствована с помощью итераций уточнения реального пространства в Phenix 47 и уточнения вручную в Coot 48 . Модель пропионата и библиотеку ротамеров генерировали с помощью сервера PRODRG 49 , стыковали с помощью Coot и уточняли в Phenix. Окончательная проверка модели карты проводилась с использованием Molprobity и EMRinger в Phenix.
Сайт-направленный мутагенез Генерацию мутантов OR51E2 проводили, как описано ранее 50. Прямые и обратные праймеры, кодирующие интересующую мутацию, были получены от Integrated DNA Technologies. Были проведены два последовательных цикла ПЦР с использованием полимеразы Phusion (Thermo Fisher Scientific: F-549L) для амплификации OR с мутациями. Первый раунд ПЦР генерировал два фрагмента, один из которых содержал 5'-область выше сайта мутации, а другой - 3'-нижнюю область. Вторая ПЦР-амплификация соединяла эти два фрагмента с получением полной ORF обонятельного рецептора. Продукты ПЦР нужной длины очищали в геле и клонировали в сайты MluI и NotI вектора экспрессии млекопитающих pCI (Promega), который содержит rho-метку. Плазмиды очищали с использованием набора минипрепаратов Thomas Scientific (1158P42) с модифицированным протоколом, включающим фенол-хлороформную экстракцию перед колоночной очисткой.
анализы передачи сигналов цАМФ Анализ ц®АМФ GloSensor (Promega) использовали для определения уровней цАМФ в реальном времени после активации OR в клетках HEK293T, как описано ранее 51 . Клетки HEK293T культивировали в минимальной основной среде (MEM, Corning) с добавлением 10% эмбриональной телячьей сыворотки (Э€Т©=FB$, ₾'ib©° [Gibco]), 0,5% пенициллина-стрептомицина (₾'ib©° [Gibco]) и 0,5% амфотерицина В (₾'ib©° [Gibco]).
Культивируемые клетки HEK293T высевали за день до трансфекции при 1/10 100% слияния из 100-мм планшета в 96-луночные планшеты, покрытые поли-D-лизином (Corning). В каждый 96-луночный планшет трансфицировали 10 мкг плазмиды pGloSensor-20F (Promega) и 75 мкг Rho-меченого OR в векторе экспрессии pCI для млекопитающих (Promega) за 18–24 ч до стимуляции запаха с использованием липофектамина 2000 (Invitrogen: 11668019). в MEM добавлено 10% FBS. В день стимуляции в планшеты вводили 25 мкл субстрата GloSensor (Promega) и инкубировали в течение 2 часов в темноте при комнатной температуре и в среде без запаха. Одоранты разбавляли до желаемой концентрации в среде CD293 (₾'ib©° [Gibco]) с добавлением меди (30 мкМ CuCl 2, Sigma-Aldrich) и 2 мМ L-глютамина (₾'ib©° [Gibco]), а рН доводили до 7,0 с помощью 150 мМ раствора гидроксида натрия (Sigma-Aldrich). После введения в каждую лунку 25 мкл отдушки в среде CD293 сразу же регистрировали люминесценцию GloSensor в течение 20 циклов мониторинга в течение 30 минут с использованием планшет-ридера BMG Labtech POLARStar Optima. Результирующую люминесцентную активность нормализовали к контрольному вектору, лишенному какого-либо OR, и ответ OR получали путем суммирования отклика от всех 20 циклов для определения площади под кривой (AUC). Дозозависимые ответы OR были проанализированы путем подгонки функции наименьших квадратов к данным с использованием GraphPrism 9.
Оценка экспрессии клеточной поверхности Проточная цитометрия использовалась для оценки экспрессии обонятельных рецепторов на клеточной поверхности, как описано ранее 52 . Клетки HEK293T высевали на 35-мм планшеты (Greiner Bio-One) приблизительно с 3,5×10 5 клеток (25% слияние). Клетки культивировали в течение ночи. Через 18-24 часа 1200 нг ОР, меченных первыми 20 аминокислотами родопсина человека (rho-tag) на N-концах 53в pCI (Promega) и 30 нг eGFP трансфицировали с использованием липофектамина 2000 (Invitrogen: 11668019). Через 18-24 часа после трансфекции клетки отделяли и ресуспендировали с помощью стриппера для клеток (Corning), а затем переносили в полистироловые пробирки с круглым дном (PS) объемом 5 мл (Falcon) на льду. Клетки центрифугировали при 4°C и ресуспендировали в фосфатно-солевом буфере (PBS, ₾'ib©° [Gibco]), содержащем 15 мМ NaN3 (Sigma-Aldrich) и 2% FBS (₾'ib©° [Gibco]). Их окрашивали 1/400 (об./об.) клона 4D2 первичного антитела мыши против родопсина (Sigma-Aldrich: MABN15) и инкубировали в течение 30 минут, затем промывали PBS, содержащим 15 мМ NaN3 и 2% FBS. Клетки снова центрифугировали, а затем окрашивали 1/200 (об./об.) конъюгированного с фикоэритрином (РЕ) ослиного антитела против мышиного фрагмента F(ab')2 (Jackson Immunologicals: 715-116-150) и инкубировали в течение 30 минут в темноте. Для маркировки мертвых клеток добавляли 1/500 (об./об.) 7-аминоактиномицина D (Calbiochem: 129935). Затем клетки были немедленно проанализированы с использованием проточного цитометра BD FACSCanto II с гейтированием, позволяющим выявить GFP-положительные, одиночные, сферические, жизнеспособные клетки, а измеренная интенсивность флуоресценции PE была проанализирована и визуализирована с помощью Flowjo v10.8.1. Нормализацию уровней экспрессии клеточной поверхности мутантов OR51E2 проводили с использованием OR51E2 дикого типа, который демонстрировал устойчивую экспрессию клеточной поверхности, и пустую плазмиду pCI, которая не демонстрировала заметной экспрессии клеточной поверхности. сферические, жизнеспособные клетки и измеренные интенсивности флуоресценции PE анализировали и визуализировали с помощью Flowjo v10.8.1. Нормализацию уровней экспрессии клеточной поверхности мутантов OR51E2 проводили с использованием OR51E2 дикого типа, который демонстрировал устойчивую экспрессию клеточной поверхности, и пустую плазмиду pCI, которая не демонстрировала заметной экспрессии клеточной поверхности. сферические, жизнеспособные клетки и измеренные интенсивности флуоресценции PE анализировали и визуализировали с помощью Flowjo v10.8.1. Нормализацию уровней экспрессии клеточной поверхности мутантов OR51E2 проводили с использованием OR51E2 дикого типа, который демонстрировал устойчивую экспрессию клеточной поверхности, и пустую плазмиду pCI, которая не демонстрировала заметной экспрессии клеточной поверхности.
Моделирование молекулярной динамики Все МД-симуляции были выполнены с использованием пакета GROMACS 54 (версия 2021) с силовым полем CHARMM36m 55 , начиная с ЭМ структуры OR51E2 с пропионатом и без него. Белок G был удален во всех этих симуляциях. Структуры GPCR были подготовлены модулем Maestro «мастер подготовки белка» 56 . Добавляли недостающие боковые цепи и атомы водорода. Кроме того, концы белковой цепи закрывали нейтральными ацетильными и метиламидными группами и присваивали протонированные состояния гистидина, после чего проводили минимизацию. Блок моделирования был создан с использованием CHARMM-GUI 57.. Мы использовали функцию PPM 2.0 структуры OPM (ориентация белков в мембранах) OR51E2 для выравнивания трансмембранных спиралей белковой структуры и вставили в 75% пальмитоил-олеоил-фосфатидилхолин (POPC) / 25% депротонированный гемисукцинат холестерина (CHSD). ) двухслойный. CHSD были размещены вокруг структуры GPCR. Для сольватации использовали водную модель TIP3P, а для нейтрализации добавляли 0,15 М ионов хлорида калия. Окончательные размеры системы составили около 85 × 85 × 115 Å. Система была сведена к минимуму с позиционными ограничениями (10 ккал/моль/Å 2 ) для всех тяжелых атомов GPCR и лиганда, после чего следовала стадия нагрева длительностью 1 нс, которая поднимала температуру с 0 К до 310 К в ансамбле NVT с термостатом Нозе-Гувера 58. Затем мы провели одно длительное уравновешивание липида и растворителя (1000 нс) в ансамбле NPT. Во время этапа нагревания и длительного уравновешивания на рецептор накладывали ограничения по положению: 10 ккал/моль-Å 2 , пропионат и POPC/CHSD в течение первой 1 нс. Позже ограничение по липидам было снижено с 5 ккал/моль-Å 2 до 0 ккал/моль-Å 2 с шагом 1 ккал с 5 нс моделирования на шаг. Затем POPC/CHSD позволяли свободно перемещаться в течение оставшейся части длительного уравновешивания, и окончательный снимок использовали в качестве исходной конформации для уравновешивания белка и лиганда. Позиционные ограничения были применены к белку (остова и боковой цепи) и лиганду, начиная с 5 ккал/моль-Å 2 , уменьшая до 0 ккал/моль-Å.2 с шагом 1 ккал/моль-Å 2 с симуляцией по 5 нс на шаг. Последний снимок этапа уравновешивания использовали в качестве исходной конформации для пяти производственных циклов со случайными семенами. Этот снимок также использовался в качестве эталонной конформации для всех RMSD в координатах. Давление контролировали с использованием метода Парринелло-Рахмана 59 , и система моделирования была соединена с ванной под давлением 1 бар. Во всех моделях алгоритм LINCS применяется ко всем связям и углам вод с временным шагом 2 фс, используемым для интегрирования. Мы использовали отсечку 12 Å для несвязанного взаимодействия и метод сетки частиц Эвальда 60.для лечения LJ-взаимодействия на больших расстояниях. Моментальные снимки MD сохранялись с интервалом в 20 пс. Траектории визуализировались с помощью VMD и PyMOL (система молекулярной графики, версия 2.5 Schrodinger) и анализировались с использованием пакета GROMACS (версия 2016/2019). Весь МД-анализ был выполнен на агрегированных траекториях из 5 прогонов (всего 5 × 1 мкс = 5 мкс). Тепловые карты и другие графики, связанные с МД, были созданы с помощью Graphpad Prism 9, тогда как структурные фигуры были созданы с использованием PyMOL.
Молекулярно-динамический анализ Лиганд-рецепторные и внутримолекулярные взаимодействия Частота контактов рассчитывалась с помощью модуля «get_contacts» ( https://getcontacts.github.io/ ). Были рассчитаны следующие типы взаимодействия между лигандом и рецептором: водородные связи, гидрофобные и ван-дер-ваальсовы взаимодействия.
Расчет остаточных расстояний Для расстояния между двумя остатками мы использовали gmx mindist (пакет GROMACS 2016/2019), который вычисляет минимальное расстояние между двумя атомами (например, боковой цепью, Cα, кислородом, азотом) одного из каждого остатка с течением времени. Анализ расстояния на статических конструкциях был выполнен с использованием инструмента измерения в PyMOL. Выбранные атомы для расчета расстояния описаны в каждой легенде.
Ротамерный анализ F250 Для ротамерного анализа представляющих интерес остатков мы использовали tcl-скрипт VMD «Calculate_dihedrals» ( https://github.com/aiasja/calculate_dihedrals ).
Конформационная кластеризация Чтобы выбрать репрезентативные снимки из моделирования МД, показанные на рис. 4i и рис. 5b , мы сгруппировали ( кластер gmx , пакет GROMACS 2016/2019) агрегированные траектории с использованием атомов основной цепи трансмембранной спирали. Порог RMSD для кластеризации был установлен на уровне 0,08 нм для моделирования с пропионатом, 0,085 нм для моделирования WT без лиганда и 0,085 нм для моделирования Q181D без лиганда. Для кластеризации пропионата ( рис. 2f ) мы использовали отсечку RMSD 0,01 нм для лиганда.
Среднеквадратичное отклонение (RMSD) Функция gmx rms (пакет GROMACS 2016/2019) использовалась для определения стабильности моделирования. Для этого мы использовали трансмембранную основу OR51E2, выбрав следующие остатки: 23–50 (TM1), 57–86 (TM2), 93–126. (ТМ3), 137–164 (ТМ4), 191–226 (ТМ5), 230–264 (ТМ6) и 269–294 (ТМ7). В качестве эталона мы использовали уравновешенную структуру MD связанного пропионата, апо и Q181D OR51E2. Чтобы оценить стабильность лиганда в связывающем кармане с течением времени, СКО пропионата рассчитывали, используя в качестве эталона уравновешенную структуру MD связанного с пропионатом.
Объем кармана для связывания лиганда Объем и площадь поверхности связывающего пропионат кармана в OR51E2 рассчитывали с использованием модуля Maestro SiteMap 61 , 62 . Для расчета объема использовались три структуры: 1) крио-ЭМ структура OR51E2, связанная с пропионатом, 2) модель OR51E2-L158A, связанная с гексаноатом, 3) модель OR51E2-F155A, связанная с октаноатом. Чтобы подготовить модели L158A и F155A, мы использовали функцию мутации Maestro, чтобы ввести замены в крио-ЭМ структуру OR51E2; затем эти модели были минимизированы по энергии с использованием модуля ProteinPreparationWizard с параметрами по умолчанию 56 . Затем мы использовали Maestro Glide Docking 63 – 65.для стыковки гексаноата и октаноата с полученными моделями OR51E2-L158A и OR51E2-F155A соответственно. Мы подготовили блок стыковочной сетки как для OR51E2-L158A, так и для OR51E2-F155A, определив блок с центром в пропионате и длиной блока 2,5 нм. Стыковку лиганда Glide выполняли с использованием точности XP и параметров по умолчанию, чтобы получить модель для OR51E2-L158A, связанного с гексаноатом, и OR51E2-F155A, связанного с октаноатом. Чтобы рассчитать объемы сайта связывания лиганда с помощью модуля SiteMap, мы определили карман связывания лиганда как максимум 0,6 нм вокруг выбранного лиганда (пропионат/гексаноат/октаноат) с не менее чем 15 точками сайта (зондами) на указанный сайт. Размер сетки для зондов был установлен на 0,035 нм. Используя этот подход, рассчитанные объемы для OR51E2 дикого типа, OR51E2-L158A и OR51E2-F155A составили 31 Å 3 , 68 Å.3 и 90 Å 3 соответственно.
Филогенетическое дерево Филогенетическое дерево GPCR класса А человека было построено путем анализа 677 последовательностей. Из них 390 последовательностей были от обонятельных рецепторов (56 OR класса I и 334 OR класса II), а 287 были от необонятельных GPCR класса A. Последовательности были выровнены с Clustal 66 на Jalview 2.11.2.5 67 . В R studio 202.07.01 чтение выравнивания и расчет матрицы расстояния между последовательностями (по идентичности последовательностей) выполнялись с помощью пакетов BiostrinG s 68 и seqinr 69 . Дерево с соседним соединением и визуализация дерева были реализованы с помощью пакетов ape 70 и ggtree 71 , а дерево построено без корней методом дневного света.
Доступность данных Координаты для пропионатных OR51E2-G были депонированы в PDB RCSB под кодом доступа 8F76. Карты плотности ЭМ для OR51E2-Gs и домена 7TM OR51E2 были депонированы в Банке данных электронной микроскопии под кодами доступа EMD-28896 и EMD-28900 соответственно. Траектории моделирования МД депонированы в базе данных GPCRMD.
Взносы CBB, CADM, WJCvdV, NV, HM и AM разработали исследование. Клонированные конструкции CBB, приготовленные бакуловирусы, экспрессированные и очищенные реагенты для образования комплексов с G-белком, а также оптимизированное крупномасштабное производство OR51E2. CBB разработала условия для биохимической очистки и стабилизации комплекса OR51E2-G, связанного с пропионатом , и определила оптимальные процедуры подготовки крио-ЭМ сетки после скрининга, сбора и обработки крио-ЭМ данных 200 кВ. BF и AM выполнили сбор крио-ЭМ данных 300 кВ. CBB определил крио-ЭМ-карты высокого разрешения с помощью обширной обработки изображений с использованием данных, полученных от AMAM, и построил CBB уточненные модели связанного с пропионатом OR51E2 в комплексе с G sи Кb35. CBB и AM проанализировали крио-ЭМ данные и модели и подготовили рисунки и таблицы. CADM и JT проанализировали модели и последовательности OR для конструирования и клонирования мутантов OR, провели эксперименты по передаче сигналов Glossensor для функциональной активности OR и получили данные экспрессии OR на клеточной поверхности с помощью проточной цитометрии с использованием данных, полученных от HMCADM, и JT проанализировали и подготовили рисунки и таблицы для передачи сигналов и потока. данные цитометрии. CADM построил филогенетическое дерево OR и не обонятельных GPCR класса A. NM настроил моделирование молекулярной динамики, стыковку лигандов и выполнил расчеты объема кармана связывания. WJCvdV проанализировал траектории моделирования и подготовил рисунки, описывающие данные моделирования. WJCvdV, NM и NV предоставили механистическую информацию на основе данных моделирования. КЛДТ выполнили биоинформационный анализ OR и не обонятельной консервации класса A GPCR. LL и CBB провели экспериментальные исследования передачи сигналов GloSensor в суспензионных клетках. CBB, CADM и AM написали первоначальный проект рукописи и сгенерировали рисунки с участием всех авторов. Дальнейшие правки рукописи были предоставлены WJCvdV, NM, VN и HM. В целом проект контролировался и финансировался NV, HM и AM.
Конкурирующие интересы HM получает гонорары от Chemcom, исследовательские гранты от Givaudan и гонорары консультантов от Kao.
Благодарности Мы благодарим Дэна Тосо из Cal-Cryo в QB3-Berkeley за помощь в работе с микроскопом и сборе данных. HM, CADM и JT благодарят Mengjue J. Ni и Hsiu-Yi Lu за их техническую поддержку. Эта работа была поддержана грантом Национального института здравоохранения (NIH) R01DC020353 (HM, NV и AM) и K99DC018333 (CADM). Оборудование Cryo-EM в UCSF частично поддерживается грантами NIH S10OD020054 и S10OD021741. Этот проект финансировался Программой прорывных биомедицинских исследований UCSF, частично финансируемой Фондом Сандлера. AM признает поддержку со стороны Фонда Эдварда Маллинкродта-младшего и Фонда Валле.
₽.$.
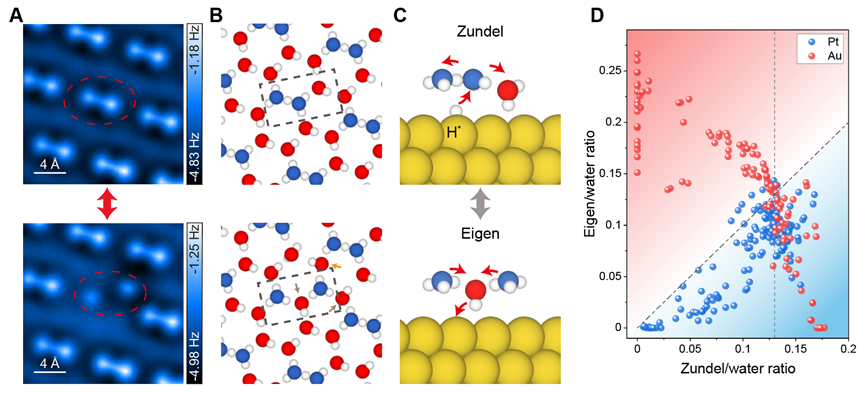
Инфракрасные отпечатки коллективной динамики воды указывают на транспорт протонов в биологических системах
вП₽ОИ©К:
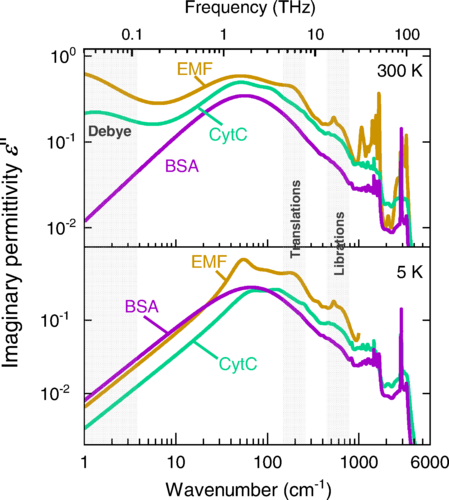
Терагерцовые инфракрасные спектры мнимых частей диэлектрической проницаемости образцов ЭМП, CytC и БСА, измеренные при 300 и 5 K. «Дебаем» обозначена субтерагерцовая часть спектров, где в спектрах обнаружен дебаевский релаксационный отклик связанной воды ЭМП и CytC. В инфракрасном диапазоне указаны частотные интервалы, в которых происходят поступательные (Т) и либрационные (Л) колебания "ЧАС2О" [h²o] молекул [d'bI] наблюдаются.
Terahertz-infrared spectra of imaginary parts of dielectric permittivity of EMF, CytC, and BSA samples measured at 300 and 5 K. “Debye” indicates the subterahertz part of the spectra where a Debye-type relaxational response of bound water is detected in the spectra of EMF and CytC. In the infrared range, frequency intervals are indicated where translational (T) and librational (L) vibrations of
H
2
O
molecules are observed.
ვიჼც მიხვდა, სჯობს ჩამევიდეს აკადემ გარადოკში, ქე რომ დიდი ბაუტუსკაიბანი Å დგილარიე, ე.წ. PARiS. EKEbS ეხება ვინძლო ლალებიც და ზოგადად bA℞©Å$iN@'R ბარხკაძინები ... სტრუქტურულნიც მაგ.: ViktoriA Bernadotte'₾; "თამუნდათანარუნდა", კოლასნი©ები mm.
ეტო ტრიკაზ!
Рекомендации ↵Бак Л. , Аксель Р. Новое семейство мультигенов может кодировать рецепторы запаха: молекулярная основа распознавания запаха . Ячейка 1991 г .; 65 : 175 – 187 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Малник Б. , Хироно Дж ., Сато Т. , Бак Л.Б. Комбинаторные коды рецепторов запахов . Ячейка 1999 г .; 96 : 713 – 723 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Zhao H , Ivic L , Otaki JM , Hashimoto M , Mikoshiba K , Firestein S. Функциональное выражение рецептора запаха млекопитающих . Наука 1998 ; 279 : 237 – 242 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Mayhew EJ , Arayata CJ , Gerkin RC , Lee BK , Magill JM , Snyder LL et al. Транспортные характеристики позволяют предсказать, имеет ли молекула запах . Proc Natl Acad Sci USA 2022 ; 119 : е2116576119 .OpenUrlGoogle Scholar ↵Ниимура Ю. , Мацуи А. , Тоухара К. Экстремальное расширение репертуара генов обонятельных рецепторов у африканских слонов и эволюционная динамика ортологичных групп генов у 13 плацентарных млекопитающих . Геном Res 2014 ; 24 : 1485–1496 ._ OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Малник Б. , Годфри П.А. , Бак Л.Б. Семейство генов обонятельных рецепторов человека . Proc Natl Acad Sci USA 2004 ; 101 : 2584 — 2589 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Глусман Г. , Янаи И. , Рубин И. , Ланцет Д. Полный обонятельный субгеном человека . Геном Res 2001 ; 11 : 685-702 . OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Джонс Д.Т. , Рид Р.Р. Гольф: G-белок, специфичный для обонятельных нейронов, участвующий в передаче сигнала запаха . Наука 1989 ; 244 : 790 – 795 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Пурморади А. , Ломвардас С. Выбор обонятельных рецепторов: тематическое исследование регуляции генов в системе с несколькими усилителями . Curr Opin Genet Dev 2022 ; 72 : 101 – 109 .OpenUrlGoogle Scholar ↵Баттервик Дж.А. , Дель Мармол Дж. , Ким К.Х. , Кальсон М.А. , Рогов Дж.А. , Уолз Т. и другие. Крио-ЭМ структура обонятельного рецептора насекомых Orco . Природа 2018 ; 560 : 447 – 452 .OpenUrlперекрестная ссылкаGoogle Scholar ↵Дель Мармол Дж ., Йедлин М.А. , Рута В. Структурная основа распознавания запахов в обонятельных рецепторах насекомых . Природа 2021 ; 597 : 126 – 131 .OpenUrlGoogle Scholar ↵Ikegami K , de March CA , Nagai MH , Ghosh S , Do M , Sharma R et al. Структурная нестабильность и отклонение от консервативных остатков лежат в основе внутриклеточной ретенции рецепторов запахов млекопитающих . Proc Natl Acad Sci USA 2020 ; 117 : 2957–2967 . OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Saito H , Kubota M , Roberts RW , Chi Q , Matsunami H. Члены семейства RTP индуцируют функциональную экспрессию обонятельных рецепторов млекопитающих . Сотовый 2004 ; 119 : 679 – 691 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar Кук Б.Л. , Штойервальд Д. , Кайзер Л. , Грейвленд-Биккер Дж. , Ванбергем М. , Берке А.П. и соавт. Крупномасштабное производство и изучение синтетического рецептора, связанного с G-белком: обонятельный рецептор человека 17-4 . Proc Natl Acad Sci USA 2009 ; 106 : 11925 — 11930 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Катада С. , Танака М. , Тоухара К. Структурные детерминанты мембранного переноса и селективности G-белка обонятельного рецептора мыши . Дж. Нейрохим 2004 ; 90 : 1453–1463 . OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Lee SJ , Depoortere I , Hatt H. Терапевтический потенциал эктопических обонятельных и вкусовых рецепторов . Nat Rev Drug Discov 2019 ; 18 : 116 – 138 .OpenUrlGoogle Scholar ↵Фрейтаг Дж. , Людвиг Г. , Андрейни И. , Рёсслер П. , Бреер Х. Обонятельные рецепторы водных и наземных позвоночных . J Comp Physiol A 1998 ; 183 : 635 - 650 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Сайто Х. , Чи К. , Чжуан Х. , Мацунами Х. , Мейнленд Д.Д. Кодирование запаха репертуаром рецепторов млекопитающих . Научный сигнал 2009 г .; 2 : ра9 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Сюй Л.Л. , Стакхаус Б.Г. , Флоренс К. , Чжан В. , Шанмугам Н. , Сестерхенн И.А. и соавт. PSGR, новый специфичный для простаты ген, гомологичный рецептору, связанному с G-белком, сверхэкспрессируется при раке предстательной железы . Рак Res 2000 ; 60 : 6568 – 6572 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Gelis L , Jovancevic N , Veitinger S , Mandal B , Arndt H-D , Neuhaus EM et al. Функциональная характеристика рецептора запаха 51E2 в меланоцитах человека . J Biol Chem 2016 ; 291 : 17772 – 17786 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar Котло К. , Анбажаган А.Н. , Приямвада С. , Джаявардена Д. , Кумар А. , Чен Ю. и другие. Обонятельный рецептор, связанный с G-белком (Olfr-78/OR51E2), модулирует реакцию кишечника на колит . Am J Physiol Cell Physiol 2020 ; 318 : С502 — С513 .OpenUrlGoogle Scholar Vadevoo SMP , Gunassekaran GR , Lee C , Lee N , Lee J , Chae S et al. Одорантный рецептор макрофагов Olfr78 опосредует лактат-индуцированный фенотип M2 опухолеассоциированных макрофагов . Proc Natl Acad Sci USA 2021 ; 118 . doi: 10.1073/pnas.2102434118 . OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Плузник Дж.Л. , Процко Р.Дж. , Геворкян Х. , Петерлин З. , Сипос А. , Хан Дж. и соавт. Обонятельный рецептор, реагирующий на сигналы кишечной микробиоты, играет роль в секреции ренина и регуляции артериального давления . Proc Natl Acad Sci USA 2013 ; 110 : 4410 – 4415 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Flegel C , Manteniotis S , Osthold S , Hatt H , Gisselmann G. Профиль экспрессии эктопических обонятельных рецепторов определяется путем глубокого секвенирования . PLoS One 2013 ; 8 : e55368 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Накашима А. , Такеучи Х. , Имаи Т. , Сайто Х. , Киёнари Х. , Абэ Т. и другие. Независимая от агонистов активность GPCR регулирует передне-заднюю направленность обонятельных сенсорных нейронов . Сотовый 2013 ; 154 : 1314–1325 . OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Расмуссен С.Ф. , ДеВри Б.Т. , Зоу И. , Крузе А.С. , Чанг К.И. , Кобилка Т.С. и другие. Кристаллическая структура комплекса β2-адренергический рецептор-Gs-белок . Природа 2011 ; 477 : 549 – 555 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Неме Р. , Карпентер Б. , Сингхал А. , Стреге А. , Эдвардс П.С. , Уайт К.Ф. и другие. Белки Mini-G: новые инструменты для изучения GPCR в их активной конформации . PLoS One 2017 ; 12 : e0175642 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Ринг А.М. , Манглик А. , Крузе А.С. , Энос М.Д. , Вайс В.И. , Гарсия К.С. и другие. Активируемая адреналином структура β2-адренорецептора, стабилизированная сконструированным нанотелом . Природа 2013 ; 502 : 575 – 579 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Tsai C-J , Pamula F , Nehme R , Mühle J , Weinert T , Flock T et al. Кристаллическая структура родопсина в комплексе с mini-Go проливает свет на принципы селективности G-белка . Научная реклама 2018 ; 4 : eaat7052 .OpenUrlБЕСПЛАТНЫЙ полный текстGoogle Scholar ↵Силфон СКБаллестерос Дж.А. , Вайнштейн Х. [19] Интегрированные методы построения трехмерных моделей и компьютерного исследования структурно-функциональных отношений в рецепторах, связанных с G-белком . В: Силфон СК (ред.). Методы в нейронауках . Academic Press , 1995 ,стр. 366–428 .Google Scholar ↵de March CA , Kim S-K , Antonczak S , Goddard WA 3rd, Golebiowski JG Белковые рецепторы запаха: от последовательности к структуре . Наука о белках 2015 ; 24 : 1543–1548 . OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Cichy A , Shah A , Dewan A , Kaye S , Bozza T. Генетическое истощение рецепторов запахов класса I влияет на восприятие карбоновых кислот . Курр Биол 2019 ; 29 : 2687–2697 . _ е4 .OpenUrlGoogle Scholar ↵Пронин А. , Слепак В. Эктопически экспрессируемые обонятельные рецепторы OR51 E1 и OR51E2 подавляют пролиферацию и способствуют гибели клеток в клеточной линии рака предстательной железы . J Biol Chem 2021 ; 296 : 100475 .OpenUrlGoogle Scholar ↵Манглик А , Крузе А.С. Структурная основа активации рецептора, связанного с G-белком . Биохимия 2017 ; 56 : 5628 – 5634 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵de March CA , Yu Y , Ni MJ , Adipietro KA , Matsunami H , Ma M et al. Консервированные остатки контролируют активацию рецепторов запаха, связанных с G-белком млекопитающих . J Am Chem Soc 2015 ; 137 : 8611 — 8616 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Bushdid C , de March CA , Topin J , Do M , Matsunami H , Golebiowski J. Одорантные рецепторы млекопитающих класса I демонстрируют консервативный вестибулярно-связывающий карман . Cell Mol Life Sci 2019 ; 76 : 995-1004 ._ OpenUrlGoogle Scholar ↵Shim T , Pacalon J , Kim W-C , Cong X , Topin J , Golebiowski J et al. Третья внеклеточная петля обонятельных рецепторов млекопитающих участвует в связывании лигандов . Int J Mol Sci 2022 ; 23 . дои: 10.3390/ijms232012501 . OpenUrlперекрестная ссылкаGoogle Scholar ↵Джампер Дж. , Эванс Р. , Притцель А. , Грин Т. , Фигурнов М. , Роннебергер О. и другие. Высокоточное предсказание структуры белка с помощью AlphaFold . Природа 2021 ; 596 : 583 – 589 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Асарнов Д. , Паловчак Э. , Ченг Ю. asarnow/pyem: UCSF pyem v0.5 . 2019 г.: 10.5281/zenodo.3576630 . OpenUrlперекрестная ссылкаGoogle Scholar Данг С. , Фэн С. , Тиен Дж. , Питерс С.Дж. , Балкли Д. , Лоликато М. и др. Крио-ЭМ структуры активируемого кальцием хлоридного канала TMEM16A . Природа 2017 ; 552 : 426 – 429 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Staus DP , Wingler LM , Choi M , Pani B , Manglik A , Kruse AC et al. Лигирование сортазой делает возможным гомогенное фосфорилирование GPCR, чтобы выявить разнообразие в связывании β-arrestin . Proc Natl Acad Sci USA 2018 ; 115 : 3834 – 3839 .OpenUrlАннотация / Полный текст БЕСПЛАТНОGoogle Scholar ↵Мастронард ДН. SerialEM: программа для автоматизированного сбора серии наклонов на микроскопах Tecnai с использованием прогнозирования положения образца . Микроск Микроанал 2003 ; 9 : 1182–1183 . OpenUrlперекрестная ссылкаGoogle Scholar ↵Чжэн С.К. , Паловчак Э. , Армаш Ж-П. , Верба К.А. , Ченг Ю. , Агард Д.А. MotionCor2: анизотропная коррекция движения, вызванного лучом, для улучшения криоэлектронной микроскопии . Нат Методы 2017 ; 14 : 331-332 . OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Петтерсен Э.Ф. , Годдард Т.Д. , Хуан К.С. , Мэн Э.К. , Коуч Г.С. , Кролл Т.И. _ UCSF ChimeraX: Визуализация структуры для исследователей, преподавателей и разработчиков . Белковая наука 2021 ; 30 : 70 – 82 .OpenUrlперекрестная ссылкаGoogle Scholar Шерес ШВ. РЕЛИОН: реализация байесовского подхода к определению структуры крио-ЭМ . J Struct Biol 2012 ; 180 : 519 – 530 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Кролл ТИ. ISOLDE: физически реалистичная среда для построения моделей в карты электронной плотности с низким разрешением . Acta Crystallogr D Struct Biol 2018 ; 74 : 519 – 530 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Адамс П.Д. , Афонин П.В. , Бункоци Г. , Чен В.Б. , Дэвис И.В. , Эколс Н. и др. PHENIX: комплексная система на основе Python для решения макромолекулярной структуры . Acta Crystallogr D Biol Crystallogr 2010 ; 66 : 213 – 221 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Эмсли П. , Коутан К. Кут: инструменты построения моделей для молекулярной графики . Acta Crystallogr D Biol Crystallogr 2004 ; 60 : 2126 – 2132 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Шюттелькопф А.В. , ван Аалтен ДМФ. PRODRG: инструмент для высокопроизводительной кристаллографии белково-лигандных комплексов . Acta Crystallogr D Biol Crystallogr 2004 ; 60 : 1355–1363 . OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Бушдид К. , де Марч К.А. , Мацунами Х. , Голебиовски Дж. Численные модели и анализы in vitro для изучения рецепторов запаха . Методы Мол Биол 2018 ; 1820 : 77–93 . OpenUrlперекрестная ссылкаGoogle Scholar ↵Zhang Y , Pan Y , Matsunami H , Zhuang H. Измерение активации рецепторов запаха на живых клетках с использованием анализа цАМФ в реальном времени . J VisExp 2017 . дои: 10.3791/55831 . OpenUrlперекрестная ссылкаGoogle Scholar ↵Чжуан Х. , Мацунами Х. Оценка экспрессии клеточной поверхности и измерение активации рецепторов запаха млекопитающих в гетерологичных клетках . Нацпроток 2008 ; 3 : 1402–1413 . OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Краутвурст Д. , Яу К.В. , Рид Р.Р. Идентификация лигандов обонятельных рецепторов путем функциональной экспрессии библиотеки рецепторов . Ячейка 1998 г .; 95 : 917 – 926 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Berendsen HJC , van der Spoel D , van Drunen R. GROMACS: реализация параллельной молекулярной динамики с передачей сообщений . Comput Phys Commun 1995 ; 91 : 43 – 56 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Хуан Дж. , Раушер С. , Навроцкий Г. , Ран Т. , Фейг М. , де Гроот Б.Л. и другие. CHARMM36m: улучшенное силовое поле для свернутых и внутренне неупорядоченных белков . Нат Методы 2017 ; 14 : 71-73 . OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Madhavi Sastry G , Adzhigirey M , Day T , Annabhimoju R , Sherman W. Подготовка белков и лигандов: параметры, протоколы и влияние на обогащение виртуального скрининга . J Comput Aided Mol Des 2013 ; 27 : 221-234 . OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Джо С. , Ким Т. , Айер В.Г. , Им В. CHARMM-GUI: графический веб-интерфейс пользователя для CHARMM . J Comput Chem 2008 ; 29 : 1859–1865 . OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Эванс Д.Дж. , Холиан Б.Л. Термостат Носа-Хувера . J Chem Phys 1985 ; 83 : 4069 – 4074 .OpenUrlперекрестная ссылкаСеть наукиGoogle Scholar ↵Парринелло М. , Рахман А. Полиморфные переходы в монокристаллах: новый метод молекулярной динамики . J Appl Phys 1981 ; 52 : 7182 – 7190 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Дарден Т. , Йорк Д. , Педерсен Л. Сетка частиц Эвальд: метод N·log(N) для сумм Эвальда в больших системах . J Chem Phys 1993 ; 98 : 10089 – 10092 .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Халгрен Т. Новый метод быстрой и точной идентификации и анализа сайтов связывания . Chem Biol Drug Des 2007 ; 69 : 146 – 148 .OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Халгрен Т.А. Идентификация и характеристика сайтов связывания и оценка лекарственной способности . J Chem Inf Model 2009 ; 49 : 377-389 . OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Friesner RA , Murphy RB , Repasky MP , Frye LL , Greenwood JR , Halgren TA et al. Сверхточное скольжение: стыковка и оценка с использованием модели гидрофобной оболочки для комплексов белок-лиганд . J Med Chem 2006 ; 49 : 6177-6196 . _OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar Халгрен Т.А. , Мерфи Р.Б. , Фриснер Р.А. , Берд Х.С. , Фрай Л.Л. , Томас Поллард В. и др. Glide: новый подход к быстрой и точной стыковке и подсчету очков. 2. Факторы обогащения при скрининге базы данных . Журнал медицинской химии . 2004 ; 47 : 1750–1759 гг ._OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Friesner RA , Banks JL , Murphy RB , Halgren TA , Klicic JJ , Mainz DT et al. Glide: новый подход к быстрой и точной стыковке и подсчету очков. 1. Методика и оценка точности стыковки . Журнал медицинской химии . 2004 ; 47 : 1739–1749 гг .OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Ларкин М.А. , Блэкшилдс Г. , Браун Н.П. , Ченна Р. , МакГеттиган П.А. , МакВильям Х. и другие. Clustal W и Clustal X версии 2.0 . Биоинформатика 2007 ; 23 : 2947–2948 . OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Уотерхаус А.М. , Проктер Дж.Б. , Мартин Д.А. , Клэмп М. , Бартон Г.Дж. Jalview Version 2 — редактор множественного выравнивания последовательностей и инструментальные средства анализа . Биоинформатика 2009 ; 25 : 1189–1191 . OpenUrlперекрестная ссылкапабмедСеть наукиGoogle Scholar ↵Пагес Х. , Абойн П. , Джентльмен Р. , Деброй С. Биоструны: эффективное манипулирование биологическими 370 струнами . doi: 10.18129/B9.bioc.2022 . OpenUrlперекрестная ссылкаGoogle Scholar ↵Бастолла У ,Порто М ,Роман Х ,Вендрусколо МЧариф Д. , Лобри Дж.Р. SeqinR 1.0-2: пакет, предоставленный проекту R для статистических вычислений, посвященный поиску и анализу биологических последовательностей . В: Bastolla U , Porto M , Roman HE , Vendruscolo M (ред.). Структурные подходы к эволюции последовательностей: молекулы, сети, популяции . Springer Berlin Heidelberg : Берлин, Гейдельберг ,2007 , стр. 207–232 .Google Scholar ↵Paradis E , Schliep K. ape 5.0: среда для современной филогенетики и эволюционного анализа в R. Биоинформатика 2019 ; 35 : 526-528 . _OpenUrlперекрестная ссылкапабмедGoogle Scholar ↵Сюй С , Ли Л , Луо С , Чен М , Тан В , Чжан Л и др. Ggtree: сериализованный объект данных для визуализации филогенетического дерева и данных аннотаций . iMeta 2022 . doi: 10.1002/imt2.56 . OpenUrlперекрестная ссылкаGoogle Scholar.
*П.₽.ß. = П₽ÅCTb ПRÅ₽ßy, ßbI₽ßy CE₽Д©E
©Ä₽b d'ib.